Система вектора AAV, производство AAV, трансдукция и генная терапия AAV
Адено-ассоциированный вирус (вектор AAV) - Введение
Ниже описаны ландшафт, протокол и рекомендации по системе вектора адено-ассоциированного вируса (AAV), производству AAV, трансдукции AAV и генной терапии AAV. Приведена подробная информация о клонировании плазмид вектора AAV, упаковке AAV, очистке, эволюции капсида AAV и представлении генной терапии AAV.
Адено-ассоциированный вирус (вектор AAV) - Содержание
- 1. Что такое адено-ассоциированный вирус (вектор AAV)?
- 2. Обзор генной терапии AAV
- 3. Преимущества и недостатки переноса генов с помощью вектора AAV
- 4. Структура генома AAV (ITR, Rep, Cap, VP1, VP2, VP3) и сборка вируса AAV
- 5. Жизненный цикл вируса AAV - от инфекции до регенерации
- 6. Серотипы AAV и тканевая тропность AAV
- 7. Система вектора AAV (система вектора AAV)
- 8. Инженерия AAV (эволюция капсида AAV)
- 9. Трансдукция вектора AAV - доставка генов вектора AAV in vivo
- 10. Адено-ассоциированный вирус (вектор AAV) - Протокол производства, рекомендации и ссылки
Адено-ассоциированный вирус (вектор AAV) и генная терапия AAV - База знаний
1. Что такое адено-ассоциированный вирус (вектор AAV)?
Адено-ассоциированный вирус (AAV) - это маленький вирус с одноцепочечной ДНК, член парвовируса человека, впервые описанный в 1960-х годах Бобом Атчисоном в Питтсбурге и Уоллесом Роу в NIH как контаминант в препаратах аденовируса [1,2]. Вскоре после его открытия, AAV был выделен от людей, но серологические исследования показали, что сам AAV не вызывает никаких заболеваний, несмотря на присутствие в людях, инфицированных вспомогательными вирусами, такими как аденовирус или вирус герпеса [3]. С разработкой рекомбинантных векторов AAV (rAAV) были идентифицированы гены вспомогательного аденовируса, необходимые для репликации AAV, которые можно клонировать в плазмиды для производства AAV, устраняя необходимость в вспомогательном вирусе. В настоящее время производство AAV использует систему ко-трансфекции 3 плазмид (плазмид вектора AAV с геном интереса, плазмид упаковки AAV AAV-RC (репликация и капсид AAV) и pHelper (плазмид вспомогательного AAV)) в клетках AAV-293, что значительно упрощает процесс очистки AAV.
2. Обзор генной терапии AAV
AAV доказан как наиболее отличный вектор генной терапии. На сегодняшний день проведено более 204 клинических испытаний с использованием векторов AAV для доставки генов [4], и получены многообещающие результаты генной терапии на этапах Phase 1, Phase 2 и Phase 3 для большого числа заболеваний (Таблица 1), включая дефицит липопротеинлипазы (LPLD) [5], спинальную мышечную атрофию (SMA) [6], ретинальную дистрофию [7,8], муковисцидоз [9,10], мышечную дистрофию Дюшенна [11], гемофилию [12], застойную сердечную недостаточность [13], болезнь Паркинсона [14] и ревматоидный артрит [15,16]. Среди них Luxturna от Spark была одобрена FDA для лечения пациентов с ретинальной дистрофией, AVXS-101 от AveXis показал выдающиеся терапевтические эффекты у пациентов с спинальной мышечной атрофией, в то время как AAV с микродистрофином и коагуляционным фактором IX продемонстрировали большой потенциал в лечении мышечной дистрофии Дюшенна и гемофилии соответственно.
a)Luxturna для лечения ретинальной дистрофии
FDA одобрило LUXTURNA™ (воретиген непарвовек-рзил), одноразовый продукт генной терапии, предназначенный для лечения пациентов с LCA (врожденная амаврозия Лебера) с подтвержденной биаллельной мутацией RPE65, связанной с ретинальной дистрофией в декабре 2017 года. LUXTURNA является первым и единственным фармакологическим лечением для наследственного заболевания сетчатки (IRD) и первой генной терапией вектора AAV для генетического заболевания, одобренной в США. LUXTURNA использует AAV2 для доставки функциональных копий гена RPE65 в клетки пигментного эпителия сетчатки (RPE), чтобы компенсировать мутацию RPE65 [17]. С доставкой функционального гена RPE65, клетки пигментного эпителия сетчатки начинают производить белок RPE65 [18], позволяя регенерировать 11-cis-ретиналь (важный компонент зрительного пигмента), восстанавливая зрительный цикл [4,19]. На сегодняшний день исследования Phase 1 показали
потенциальные преимущества замены генов при ретинальной дистрофии, опосредованной RPE65, а исследования Phase 3 также демонстрируют высокую эффективность и безопасность генной терапии Luxturna у участников с наследственной ретинальной дистрофией [20].
| Indication | Gene | AAV serotype | Route of AAV delivery | Phase | Sponsor |
| Lipoprotein lipase deficiency | LPL | AAV1 | Intramuscular | II–Ⅲ | Amsterdam Molecular Therapeutics |
| LPL | AAV1 | Intramuscular | Ⅰ | UniQure Biopharma B.V. | |
| Spinal muscular atrophy 1 | SMN | AAV9 | Intravenous | Ⅰ | AveXis |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| Spinal muscular atrophy | SMN | AAV9 | Intravenous | Ⅰ | AveXis |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| Retinal dystrophy | RPE65 | AAV2 | Subretinal | Ⅰ–Ⅱ | University College, London |
| PDE6B | AAV5 | Subretinal | Ⅰ–Ⅱ | Horama S.A | |
| Cystic fibrosis | CFTR | AAV5 | Lung, via aerosol | Ⅰ | NIDDK |
| Hemophilia A | HLP-FVIII-V3 | AAV8 | Intravenous | Ⅰ | University College, London |
| Hemophilia B | FIX | AAV2 | Intravenous | Ⅰ | Spark Therapeutics |
| FIX16 | AAVrh10 | Intravenous | Ⅰ–Ⅱ | Ultragenyx Pharmaceutical Inc | |
| Arthritis | TNFR:Fc | AAV2 | Intraarticular | Ⅰ | Targeted Genetics Corporation |
| TNFR:Fc | AAV2 | Intraarticular | Ⅰ–Ⅱ | Targeted Genetics Corporation | |
| hIFN-b | AAV5 | Intraarticular | Ⅰ | Arthrogen | |
| hIFN-b | AAV5 | Intraarticular | Ⅰ | Arthrogen | |
| Congestive heart failure | SERCA2a | AAV1 | Intracoronary | Ⅰ–Ⅱ | Celladon Corporation |
| SERCA2a | AAV1 | Intracoronary | Ⅱ | Celladon Corporation | |
| SERCA2a | AAV1 | Intracoronary | Ⅱ | Imperial College London | |
| SERCA2a | AAV1 | Intracoronary | Ⅱ | Assistance Publique - Hôpitaux de Paris | |
| SERCA2a | AAV1 | Intracoronary | Ⅰ–Ⅱ | Celladon Corporation | |
| Parkinson's disease | GAD | AAV2 | Surgical infusion | Ⅰ | Neurologix, Inc. |
| GAD | AAV2 | Intrastriatal | Ⅰ | Genzyme, a Sanofi Company | |
| NTN | AAV2 | Intrastriatal | Ⅰ | Genzyme | |
| NTN | AAV2 | Bilateral Intraputaminal (IPu) | Ⅱ | Genzyme | |
| NTN | AAV2 | Bilateral Intraputaminal and Intranigral | Ⅰ–Ⅱ | Sangamo Therapeutics | |
| Alzheimer's disease | NGF | AAV5 | Bilateral, stereotactic | Ⅰ | Ceregene |
| APOE2 | AAVrh.10 | Intracisternal | Ⅰ | Weill Medical College of Cornell University |
b)AVXS-101 для лечения спинальной мышечной атрофии (SMA)
AVXS-101 разрабатывается компанией AveXis (принадлежащей Novartis) для доставки функциональной копии гена SMN1 с использованием вектора AAV9 в двигательные нейроны пациентов с SMA [21]. Трансген SMN1 в AVXS-101 содержит двухцепочечную ДНК, что означает, что он состоит из генетических инструкций и принимает такую же форму, как и естественные гены, что позволяет ему быстрее активироваться для производства устойчивого белка SMN, обеспечивая более эффективную генную терапию in vivo. Безопасность, переносимость и впечатляющие улучшения двигательных функций у всех пациентов с SMA 1 типа были подтверждены в ходе клинических испытаний фазы 1 [51]. Основываясь на предварительных основных результатах, FDA присвоило AVXS-101 статус орфанного препарата для лечения всех типов SMA, статус прорывной терапии и статус ускоренного одобрения для лечения SMA 1 типа. Аналогичным образом, Европейское
агентство по лекарственным средствам (EMA) также предоставило AveXis доступ к программе PRIME (PRIority Medicines) для AVXS-101 для лечения SMA 1 типа в январе 2017 года. В декабре 2017 года AveXis также объявила о начале открытого, многоцентрового сравнительного исследования фазы 1, известного как STRONG, для оценки безопасности, оптимальной дозировки и подтверждения концепции эффективности генной терапии AVXS-101 в двух различных возрастных группах пациентов с SMA 2 типа. В настоящее время AveXis проводит исследование фазы 3, называемое STR1VE (NCT03306277), у младенцев с SMA 1 типа, чтобы лучше понять безопасность генной терапии AVXS-101 и насколько хорошо AVXS-101 может работать у пациентов с SMA, что может принести новую надежду детям и взрослым пациентам с другими типами заболеваний двигательных нейронов.
c)AAV с микро-дистрофином для лечения мышечной дистрофии Дюшенна
Мышечная дистрофия Дюшенна (DMD), вызванная мутацией гена дистрофина, является серьезным генетическим заболеванием, вызывающим дегенерацию и некроз мышц по всему телу у мальчиков и молодых мужчин [22]. Согласно теории генной терапии, замена или исправление мутировавшего гена дистрофина на функциональный ген может вылечить это заболевание [23]. Однако огромный размер cDNA дистрофина и распределение мышц по всему телу представляют собой серьезные препятствия для этой задачи. Для преодоления этих препятствий исследователи разработали сильно сокращенный ген микро-дистрофина и спроектировали системную доставку гена с использованием AAV2.5, который является трансляционно оптимизированным вариантом AAV, индуцирующим более сильную трансдукцию в скелетных мышцах по сравнению с AAV2 и демонстрирующим более низкую кросс-реактивность с нейтрализующими антителами к AAV2 [11]. На сегодняшний
день данные доклинических исследований показывают, что внутрисосудистая доставка микро-дистрофина с использованием AAV может значительно улучшить патологию мышц, усилить мышечную силу и уменьшить дистрофическую кардиомиопатию у животных, таких как мыши и собаки [24,25]. Клинические испытания фазы 1 AAV2.5 у пациентов с DMD показали, что рационально спроектированный вектор AAV (AAV2.5) является безопасным и хорошо переносимым, создавая основу для настройки векторов AAV, наилучшим образом соответствующих клиническим целям [11]. В то же время необходимы дополнительные клинические испытания для оценки клинической эффективности AAV2.5 с микро-дистрофином, и результаты показывают большие перспективы для системной терапии DMD с использованием синтетического вектора AAV с микро-дистрофином [26].
d)AAV с коагуляционным фактором IX для лечения гемофилии B
Гемофилия B (HB) является заболеванием, связанным с X-хромосомой, вызванным дефицитом функционального коагуляционного фактора IX (FIX) [27]. В настоящее время данные доклинических исследований показывают, что вектор-опосредованная доставка гена коагуляционного фактора IX в скелетные мышцы или печень приводит к длительному исправлению гемофилии B у мышей и собак [28,29]. Два начальных клинических исследования фазы I/II с доставкой гена FIX cDNA с использованием векторов AAV для лечения гемофилии B не показали серьезных побочных эффектов, но продемонстрировали противоположные результаты: отсутствие терапевтического уровня FIX в мышцах, но некоторые терапевтические эффекты, сходные с таковыми у гемофилических собак [30]. На сегодняшний день генотерапия гемофилии B с использованием системного введения векторов AAV, содержащих оптимизированный коагуляционный фактор IX, достигла
значительного прогресса, улучшая фенотип кровотечения у многочисленных пациентов [31]. Однако остаются вызовы для длительной генотерапии у пациентов, и требуется дальнейшая работа для улучшения долгосрочного выражения фактора IX посредством оптимизации вектора AAV, трансгенного кассеты и стратегии коррекции.
3. Преимущества и недостатки генной доставки с помощью вектора AAV
a) Преимущества генной доставки с помощью AAV
AAV стал очень привлекательным кандидатом для создания вирусных векторов для генной терапии и создания изогенных моделей заболеваний человека благодаря различным преимуществам. 1) Высший уровень биобезопасности. На сегодняшний день дикий тип AAV не вызывает заболеваний in vivo, и дальнейшая безопасность рекомбинантной генной доставки AAV обеспечивается после удаления большинства элементов генома AAV. 2) Низкая иммуногенность. AAV вызывает очень слабую иммунную реакцию in vivo, что подтверждает его очевидное отсутствие патогенности во время генной доставки. 3) Широкий диапазон инфекционности. AAV может инфицировать как делящиеся, так и неделящиеся клетки in vivo, что позволяет доставлять гены в очень разнообразные типы клеток. 4) Стабильное выражение. Долгосрочная генная доставка in vivo может быть опосредована с помощью AAV.
b) Недостатки генной доставки с помощью AAV
Несмотря на то, что аденовирус приносит значительную пользу для лечения заболеваний, у него также есть некоторые недостатки.
1) Основным недостатком является ограниченная клонирующая емкость вектора (менее 4,7 kb), что ограничивает его использование для доставки больших генов.(Таблица 3) [32]. 2) Образование нейтрализующих антител против AAV у нечеловекообразных приматов (NHP) и человека может снизить эффект лечения с использованием генной терапии AAV [33].
| Comparison | Retrovirus | Lentivirus | Adenovirus | AAV |
| Genome | ss RNA | ss RNA | ds DNA | ss DNA |
| Integration | Yes | Yes | No | No |
| Packaging Capacity | 3kb | 4kb | 5.5kb | 2kb |
| Time to peak expression | 72h | 72h | 36h-72h | Cell: 7 days; Animals: 2 weeks |
| Sustainable time | About 3 weeks | Stable expression | Transient expression | > 6 months |
| Cell Type | Most Dividing | Most Dividing/Non-Dividing Cells | Most Dividing/Non-Dividing Cells | Most Dividing/Non-Dividing Cells |
| Titer | 10^7 TU/ml | 10^8 TU/ml | 10^11 PFU/ml | 10^12 vg/ml |
| Animal experiment | Suitable | Low efficiency | Lowest efficiency | Most suitable |
| Immune Response | High | Medium | Medium | Ultra-low |
4. Структура генома AAV (ITR, Rep, Cap, VP1, VP2, VP3) и сборка вируса AAV
Оболочка AAV имеет диаметр примерно 25 нм и заключает в себе одноцепочечный ДНК-геном размером 4,7 килобазы. Геном состоит из двух больших открытых рамок считывания (ORF), окруженных 145 парами оснований инвертированных концевых повторов (ITR), которые являются единственными цис-действующими элементами, необходимыми для репликации генома AAV и упаковки AAV. Левый ORF кодирует четыре репликационных белка (Rep40, Rep52, Rep68 и Rep78), отвечающие за специфическую интеграцию, а также за регулирование начала формирования капсида AAV в геноме AAV, тогда как правый ORF кодирует структурные белки вируса (VP1, VP2 и VP3), которые взаимодействуют между собой для сборки икосаэдральных вирионных оболочек, каждая из которых состоит из 60 субъединиц (Рисунок 1).
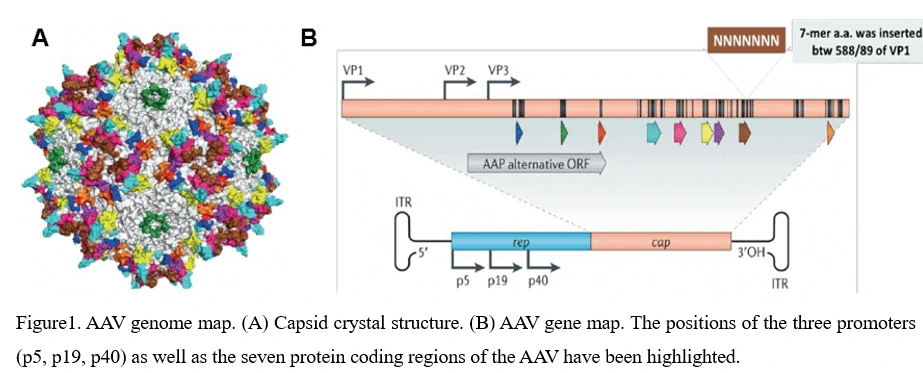
5. Жизненный цикл вируса AAV - от заражения до регенерации
AAV транздуцирует клетки через несколько стадий: (1) связывание вируса с рецептором/корецептором на поверхности клетки, (2) эндоцитоз вируса, (3) внутриклеточный транспорт вируса через эндосомальный компартмент, (4) выход вируса из эндосомы, (5) внутриклеточный транспорт вируса к ядру и ядерный импорт, (6) расщепление вириона, (7) конверсия генома вируса из одноцепочечного в двуцепочечный, способного к экспрессии кодируемого гена [34-36]. Поскольку AAV не может кодировать полимеразы, он зависит от активности клеточной полимеразы для репликации своего собственного генома [37]. Наличие вспомогательного вируса, такого как аденовирус, необходимо для диких типов AAV, чтобы способствовать экспрессии генов и репликации. (Рисунок 2A) Без вспомогательного вируса экспрессия Rep68/Rep78 будет ограничена из-за репрессии промотора P5 белком Ying Yang 1 (YY1), что приводит к ингибированию репликации генома AAV и экспрессии генов и началу интеграции хромосомы AAV (Рисунок 2B) [38]. AAV устанавливает латентность, специфически интегрируясь в геномный сайт, называемый сайтом интеграции адено-ассоциированного вируса 1 (AAVS1), представляющий собой 4-кб область на хромосоме 19 (q13.4).
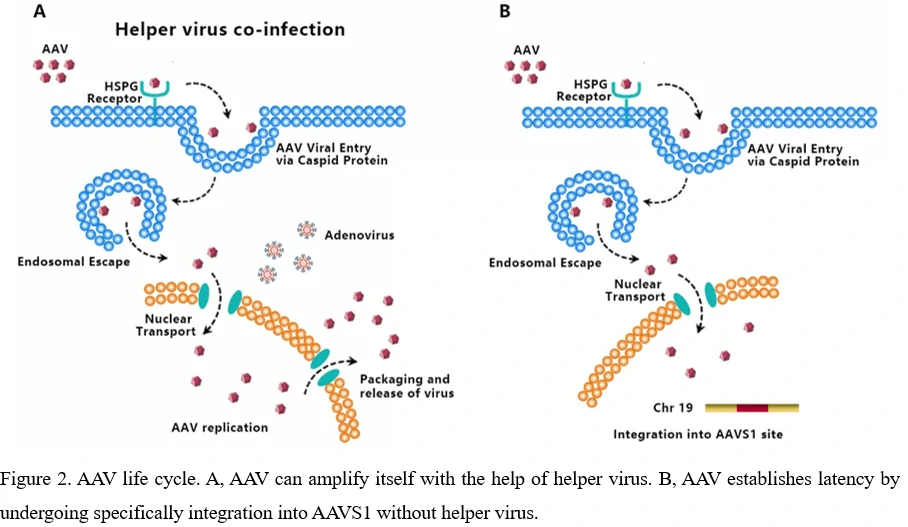
На сегодняшний день не известно ни одного заболевания, связанного с AAV, хотя AAV был обнаружен в многих тканях различных видов животных. Серологические исследования показывают, что большинство людей подвергаются воздействию диких типов AAV в детстве и подростковом возрасте, а уровень антител превышает 60% среди взрослых, при этом не наблюдается никаких вредных эффектов или литических инфекций [39,40].
6. Серотипы AAV и тканевая тропность AAV
За последние десятилетия было выявлено множество серотипов AAV с различной тропностью. На сегодняшний день из аденовирусных запасов или тканей человека/нечеловеческих приматов было изолировано 12 серотипов AAV и более 100 вариантов AAV. Среди них AAV2, AAV3, AAV5, AAV6 были обнаружены в клетках человека, тогда как AAV1, AAV4, AAV7, AAV8, AAV9, AAV10 (AAVrh10), AAV11, AAV12 были обнаружены в образцах нечеловеческих приматов [41]. Различия в геномах различных серотипов сосредоточены на гипервариабельных областях (HVR) вирусного капсида, что может определять их тканевую тропность[42]. Помимо вирусного капсида, тканевая тропность AAV-векторов также зависит от рецепторов на поверхности клеток, внутриклеточного поглощения, внутриклеточной обработки, доставки в ядро векторного генома, расщепления и конверсии одноцепочечной ДНК в двуцепочечную [3]. Чтобы эффективно осуществлять трансдукцию тканей или ограничивать тропность AAV до определенных тканей in vivo, исследователи разработали множество мозаичных AAV-векторов или химерных AAV-векторов, создав пользовательские капсиды AAV для проведения генной терапии [43,44].
a) Серотип AAV2 (AAV2)
Серотип AAV2 (AAV2) является первым выделенным серотипом AAV и также самым изученным, который обладает естественной тропностью к скелетным мышцам [45], нейронам [46], клеткам гладкой мускулатуры сосудов [47] и гепатоцитам [48]. AAV2 имеет три рецептора, среди которых гепарансульфат протеогликан (HSPG) выполняет функцию основного рецептора для улавливания частиц AAV и снижает эффективность инфекции [49], тогда как интегрин αVβ5 и рецептор фактора роста фибробластов 1 (FGFR-1) позволяют AAV проникать в клетку через рецептор-опосредованный эндоцитоз в качестве корецепторов [50-52]. AAV2 обладает отличным потенциалом для генной терапии и в настоящее время используется для лечения рака яичников (OvCa) без какого-либо воздействия на здоровые клетки [53].
b) Серотипы AAV8 и AAV9
Помимо AAV2, наиболее широко используемыми серотипами AAV являются AAV8 и AAV9. AAV8 является мощным вектором для доставки генов в печень и перспективным исследовательским инструментом для доставки генов в различные целевые органы с более высокой эффективностью, чем у большинства других серотипов. Исследования показывают, что после системной инъекции AAV8 можно обнаружить эффективную трансдукцию печени, скелетных мышц и сердца [54]. Более того, одна инъекция в хвостовую вену AAV8 была такой же эффективной, как и инъекция в воротную вену при любой дозе, и высокая доза AAV8 трансдуцировала скелетные мышцы по всему телу, включая диафрагму, всю сердечную мышцу и поджелудочную железу, гладкие мышцы и мозг на значительных уровнях [55]. По сравнению с AAV2, AAV9 демонстрирует аналогичный профиль с широко распространенной трансдукцией, но с гораздо большей эффективностью [56]. Кроме того, способность AAV9 преодолевать
гематоэнцефалический барьер (ГЭБ) позволяет использовать внутрисосудистое введение в качестве неинвазивного маршрута доставки для достижения широкой экспрессии генов в ЦНС. Более того, внутривенная доставка генов с использованием AAV9 уже показала многообещающие результаты для нескольких заболеваний в моделях животных, включая лизосомные накопительные нарушения и двигательные нейронные заболевания, открывая путь к первому клиническому испытанию в этой области [57].
c) Другие серотипы AAV
На сегодняшний день 12 серотипов AAV были разработаны как векторы для доставки генов. Интерпретировать тканевую тропность серотипов AAV может быть сложно из-за межисследовательских вариаций в титрах и дозах векторов, промоторах и трансгенах. Общая иерархия эффективности трансдукции в основных тканях и типах клеток была установлена в таблице 1 и таблице 2. Например, AAV2 может умеренно трансдуцировать несколько типов тканей, включая центральную нервную систему, печень, мышцы и легкие. Аналогично, в пределах ЦНС, AAV1 и AAV5 показывают более высокие частоты трансдукции, чем AAV2 во всех введенных регионах [58,59], тогда как AAV4, по-видимому, трансдуцирует только определенные типы клеток, такие как астроциты и эпендима в поджелудочковой зоне [60]. В клетках скелетных мышц AAV1, AAV6 и AAV7 сообщается, что они демонстрируют очень высокий уровень трансдукции [56,61-63], тогда как AAV8 демонстрирует способность трансдукции с
высокой эффективностью не только в гепатоцитах, но и в других органах [44,61,64]. В дополнение к клеткам скелетных мышц, сообщается, что AAV6 опосредует более эффективную трансдукцию эпителиальных клеток дыхательных путей в легких мышей по сравнению с AAV2 [64], что может предоставить AAV6 значительные преимущества перед AAV2 для генной терапии легочных заболеваний, таких как кистозный фиброз, учитывая низшую иммуногенность AAV6 по сравнению с AAV2 [44,61].
| AAV Serotype | Tissue tropism | |||||||
| CNS | Retina | Lung | Liver | Pancreas | Kidney | Heart | Muscle | |
| AAV1 | √ | √ | √ | √ | √ | |||
| AAV2 | √ | √ | √ | |||||
| AAV3 | √ | √ | √ | √ | ||||
| AAV4 | √ | √ | √ | |||||
| AAV5 | √ | √ | √ | √ | ||||
| AAV6 | √ | √ | √ | √ | √ | |||
| AAV7 | √ | √ | ||||||
| AAV8 | √ | √ | √ | √ | ||||
| AAV9 | √ | √ | √ | √ | √ | |||
| AAV-DJ | √ | √ | √ | √ | ||||
| AAV-DJ/8 | √ | √ | √ | |||||
| AAV-Rh10 | √ | √ | √ | √ | √ | |||
| AAV-retro | √ | √ | √ | |||||
| AAV-PHP.B | √ | √ | √ | |||||
| AAV8-PHP.eB | √ | √ | ||||||
| AAV-PHP.S | √ | √ | √ | |||||
| Cell Line | AAV1 | AAV2 | AAV3 | AAV4 | AAV5 | AAV6 | AAV8 | AAV9 | AAV-DJ | AAV-DJ/8 |
| Huh-7 | 13 | 100 | 2.5 | 0 | 0.1 | 10 | 0.7 | 0 | 500 | 0.2 |
| HEK293 | 25 | 100 | 2.5 | 0.1 | 0.1 | 5 | 0.7 | 0.1 | 500 | 0.3 |
| Hela | 3 | 100 | 2 | 0.1 | 6.7 | 1 | 0.2 | 0.1 | 667 | 0.2 |
| HepG2 | 3 | 100 | 16.7 | 0.3 | 1.7 | 5 | 0.3 | ND | 1250 | 0.5 |
| Hep1A | 20 | 100 | 0.2 | 1 | 0.1 | 1 | 0.2 | 0 | 400 | 0.1 |
| 911 | 17 | 100 | 11 | 0.2 | 0.1 | 17 | 0.1 | ND | 500 | 0 |
| CHO | 100 | 100 | 14 | 1.4 | 333 | 50 | 10 | 1 | 25000 | 5 |
| COS | 33 | 100 | 33 | 3.3 | 5 | 14 | 2 | 0.5 | 500 | 0.3 |
| MeWo | 10 | 100 | 20 | 0.3 | 6.7 | 10 | 1 | 0.2 | 2857 | 1 |
| NIH3T3 | 10 | 100 | 2.9 | 2.9 | 0.3 | 10 | 0.3 | ND | 500 | 0.1 |
| A549 | 14 | 100 | 20 | ND | 0.5 | 10 | 0.5 | 0.1 | 1000 | 0.1 |
| HT1180 | 20 | 100 | 10 | 0.1 | 0.3 | 33 | 0.5 | 0.1 | 333 | 0.2 |
| Monocytes | 1111 | 100 | ND | ND | 125 | 1429 | ND | ND | 100 | ND |
| Immature DC | 2500 | 100 | ND | ND | 222 | 2857 | ND | ND | 200 | ND |
| Mature DC | 2222 | 100 | ND | ND | 333 | 3333 | ND | ND | 100 | ND |
7. Система вектора AAV (AAV Vector System)
a) Введение в систему вектора rAAV
Хотя дикий тип AAV не ассоциируется с человеческими заболеваниями, он естественно дефектен и требует коинфекции вспомогательного аденовируса или вируса простого герпеса (HSV) для репликации AAV, поэтому рекомбинантный AAV (rAAV) стал привлекательным вектором для генной терапии. В 1984 году rAAV был впервые использован, заменяя вирусный геном на трансген, который затем был трансфицирован в клетки, инфицированные аденовирусом, для производства rAAV.
Традиционно векторы rAAV, используемые в клинических испытаниях, готовились с использованием плазмиды, содержащей терапевтический ген, окруженной инвертированными конечными повторами (ITR) AAV, и ко-трансфецированной с упаковочной плазмидой AAV AAV-RC (репликация AAV и капсид) и pHelper (вспомогательная плазмида AAV). Вспомогательные факторы аденовируса, такие как E1A, E1B, E2A, E4ORF6 и VA РНК, предоставляются третьей вспомогательной плазмидой. Поскольку клетки HEK293, обычно используемые для производства AAV, уже содержат ген E1A/E1B, только E2A, E4ORF6 и VA РНК необходимо предоставлять вспомогательной плазмидой.
b) Система rAAV без вспомогательного вируса
Текущий метод производства rAAV основан на временной трансфекции всех элементов, необходимых для производства AAV, в клетки-хозяева, такие как клетки HEK293, без использования аденовируса. Это включает ко-трансфекцию 3 плазмид в клетки для производства AAV, как показано на Рисунке 3.
1. AAV-GOI: плазмида, содержащая ITR AAV и интересующий ген (GOI);
2. AAV-RC: плазмида серотипа AAV, содержащая гены Rep и Capsid;
3. pHelper: вспомогательная плазмида AAV, предоставляющая вспомогательные гены, изолированные из аденовируса.
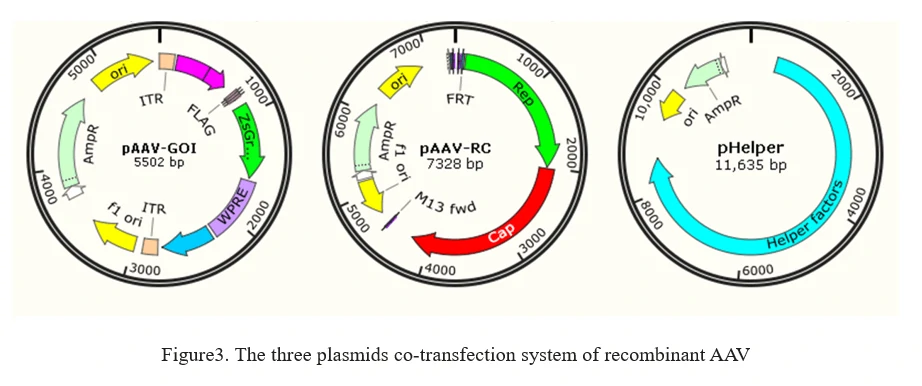
8. Инженерия AAV (эволюция капсида AAV)
Щелкните здесь, чтобы просмотреть подробности разработки реинжиниринга капсидов AAV>>
Хотя в природе найдено более 100 вариантов серотипов AAV, значительный прогресс был достигнут в производстве rAAV, эффективность трансдукции и специфичность для некоторых тканей и типов клеток у животных и приматов остаются низкими. Нецелевое доставление с помощью AAV требует высоких доз и потенциально приводит к токсичности, проблемам с производственными нагрузками и неоптимальной эффективности. Таким образом, важная область разработки AAV как вектора связана с инженерией измененных тропизмов клеток для повышения эффективности и специфичности доставки генов rAAV. Среди различных серотипов AAV различия в эффективности трансдукции могут быть вызваны различиями в содержании их соответствующих рецепторов на целевых клетках.
Было разработано множество стратегий для улучшения эффективности и специфичности доставки AAV. Методологически методы улучшения тропизма и специфичности AAV можно разделить на две категории. Один из них - сборка и рекомбинация белков между разными вирусами, что может привести к созданию гибридных rAAV. Другой - рекомбинация, редизайн или введение случайных мутаций в белок капсида AAV различными методами для искусственного увеличения разнообразия серотипов AAV, а затем отбор подходящих серотипов AAV.
a) Гибридные rAAV векторы
Один из часто используемых подходов для создания гибридных rAAV векторов - это транскапсидирование, процесс, включающий упаковку ITR одного серотипа AAV в капсид другого серотипа, что может определить тропизм тканей гибридов. Например, если предполагается производить rAAV2/5 на основе описанной выше системы без вспомогательных факторов, упаковочная плазмида AAV-RC должна быть pRep2/Cap5, то есть ген Rep получен из AAV2, а ген Capsid - из AAV5. Схема упаковки такая же, как обсуждалась выше для производства AAV2. Полученный rAAV называется rAAV2/5, и тропизм этой вирусной ткани предполагается таким же, как у AAV5.
b) Эволюция AAV
Существуют два основных способа эволюции AAV: один - это рациональное проектирование, другой - направленная эволюция (Рисунок 4).
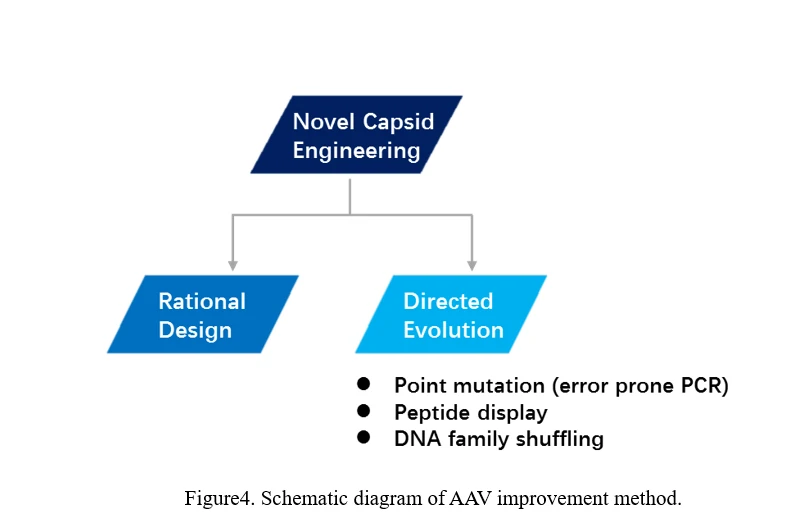
Рациональное проектирование
Некоторые из общих методов рационального проектирования капсида AAV, основанные на знаниях о механизмах доставки и структурном анализе AAV [65], перечислены ниже.
(1) Фосфорилирование остатков тирозина в капсиде AAV приводит к убиквитинированию и способствует протеасомальной деградации вирионов AAV, что приводит к созданию векторов, в которых тирозины были мутированы в фенилаланин с помощью направленного мутагенеза [66].
(2) Анализ потенциальных сайтов связывания для антитела мыши IgG2a с поверхностью AAV2 для определения доступных для стерического связывания кандидатов, которые затем подвергались обширному направленному мутагенезу для разработки вариантов с уменьшенной нейтрализацией антителами in vitro [67].
(3) Введение высокоаффинных лигандов в капсид AAV может придать способность связываться с альтернативными рецепторами на поверхности клеток и тем самым ограничить или изменить тропизм вируса [68].
Направленная эволюция AAV
Традиционный процесс направленной эволюции включает создание библиотеки с помощью ошибки полимеразы, дисплея пептидов или перестановки ДНК. Затем эта библиотека вирусов AAV упаковывается в виде пула и очищается, а затем отбирается под определенным давлением in vitro или in vivo. После инфицирования целевых клеток или тканей вирусы восстанавливаются с помощью аденовирус-опосредованной репликации или амплификации ПЦР. После трех и более раундов отбора высокоинфекционные и специфические капсидные виды AAV обогащаются (Рисунок 5) [69].
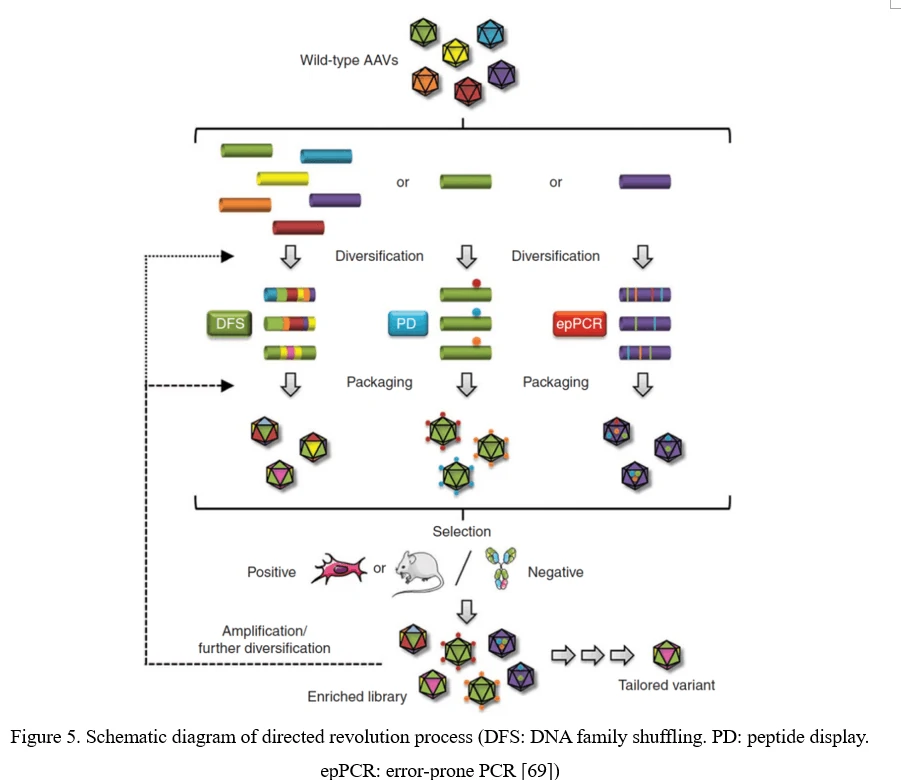
Точечная мутация (ошибка полимеразы PCR)
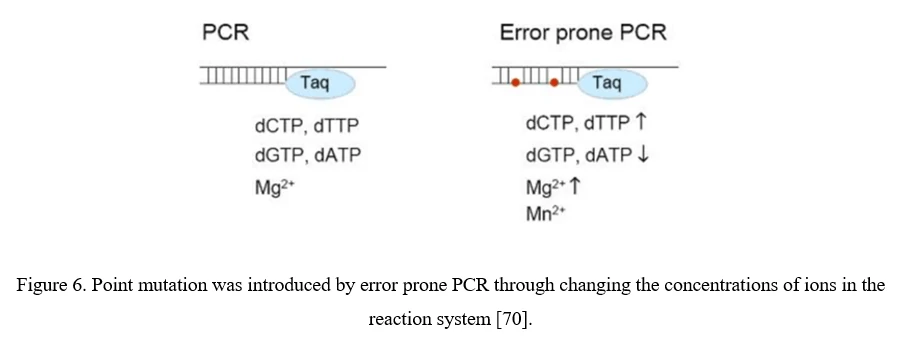
Самая простая стратегия для диверсификации AAV - это мутагенез отдельных остатков в капсиде вируса AAV либо направленным, либо случайным образом, ожидая, что введенные изменения аминокислот могут изменить основные свойства вектора AAV. Случайные мутации можно вводить в кодирующую последовательность капсида AAV с помощью ошибки полимеразы PCR (Рисунок 6).
Хотя точечные мутации легко вводятся в кодирующую последовательность капсида AAV, существуют проблемы. 1) Только 0,01–1% мутаций AAV обычно являются полезными; 2) количество клонов для покрытия всех комбинаций нескольких мутаций в одном капсиде AAV превышает технические возможности. Было бы более полезно сосредоточиться на определенной области капсида AAV, особенно на участках, выступающих на поверхности, и выступах капсида AAV, которые более вероятно взаимодействуют с клеточными рецепторами и антителами [70].
Дисплей пептидов
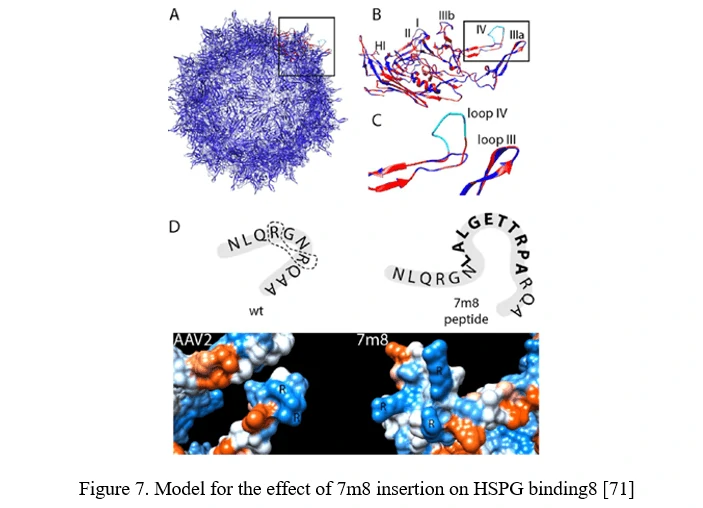
Вставка пептидов новых элементов связывания рецепторов на поверхности капсида AAV может обеспечить аффинность к рецептору, специфически экспрессируемому в целевом типе клеток. Чтобы максимально успешно использовать стратегию дисплея пептидов AAV, важно использовать участки в капсиде AAV, которые способствуют поверхностной экспозиции пептидов.
В случае AAV2 это можно достичь путем вставки до или после аргинина 588 (R588), одного из двух важных остатков, необходимых для связывания AAV2 с HSPG. В варианте AAV2-7m8 7m8 нарушает мотив связывания HSPG, разделяя аргинины (Рисунок 7) [71].
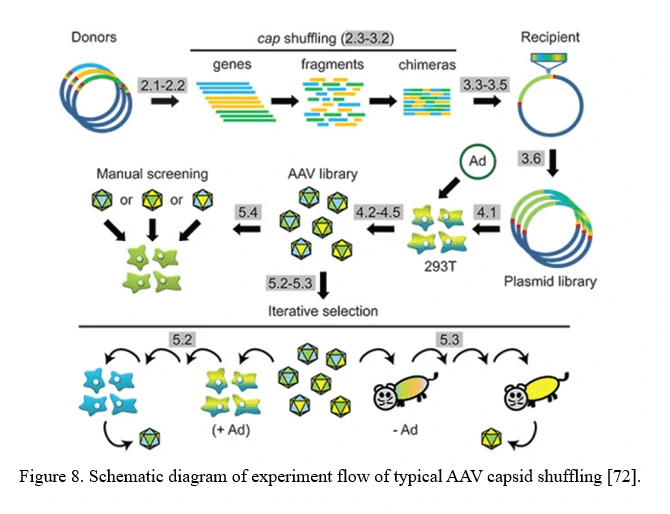
Семейная перестановка AAV (перестановка ДНК капсидов AAV)
Библиотека, кодирующая химеры капсидов, может быть создана путем семейной перестановки AAV (Рисунок 8). Фрагменты различных генов капсидов AAV реконструируются на основе частичных гомологий (обычно >80% для большинства серотипов AAV). Эта библиотека содержит химеры с широким разнообразием в тропизме клеток и устойчивости к нейтрализующим антителам.
Этот подход также может использовать и смешивать функции вновь идентифицированных серотипов AAV или даже рационально разработанных мутантов капсидов AAV, чтобы потенциально создать бесконечное количество новых вариантов с новыми свойствами [72].
9. Трансдукция вектора AAV - доставка гена вектора AAV in vivo
Для нормальных тканей или органов, таких как сердце, печень, почки, грудь, поджелудочная железа, яичники, мозг, глаза, скелетные мышцы, жировая ткань и т. д., GeneMedi систематически организует соответствующие оптимальные серотипы AAV, методы доставки генов и объемы инъекций для инфицирования тканей мышей и крыс. Рекомендуемые методы доставки генов AAV для различных органов показаны в Таблице 5.
| Infection organ | Recommended serotype | Injection route | Animal | Injection volume (μl) |
| Heart | AAV9 | Multiple points in situ | Rat | 10-15/point, 3-5 points |
| Mouse | 10-15/point, 3-5 points | |||
| Tail vein | Rat | 250 (200g body weight) | ||
| Mouse | 100 | |||
| Liver | AAV8 or AAV9 | Tail vein | Rat | 200 (200g body weight) |
| Mouse | 100 | |||
| Whole brain | AAV-PHP.eB AAV-PHP.B | Tail vein | Rat | 200 (200g body weight) |
| Mouse | 100 | |||
| Lateral ventricle | AAV9 | Stereotactic | Rat | 1-5 |
| Mouse | 1-5 | |||
| Brain tissue | AAV9 | Stereotactic | Rat | 2-3 |
| Mouse | 1-2 | |||
| Fat | AAV9 | Intraperitoneal injection for intraperitoneal fat | Rat | 300 |
| Mouse | 150-200 | |||
| in situ injection for subcutaneous fat | Rat | 10-15/point, 3-5 points | ||
| Mouse | 10-15/point, 3-5 points | |||
| Skeletal muscle | AAV1 or AAV9 | In situ injection | Rat | 10-15/point, 3-5 points |
| Mouse | 10-15/point, 3-5 points | |||
| Eyes | AAV2, AAV10 or AAV-DJ | vitreous chamber injection | Rat | 3-5 |
| Mouse | 1-3 | |||
| subretinal space injection | Rat | 1-2 | ||
| Mouse | 1-2 | |||
| Lung | AAV6 | Intratracheal injection | Rat | 100 (200g weight) |
| Mouse | 50-75 | |||
| Kidney | AAV2 or AAV9 | Renal pelvis injection | Rat | 10-15/point, 3-5 points |
| Mouse | 10-15/point, 3-5 points | |||
| Intestine | AAV1 or AAV5 | Enema | Rat | 200 (200g weight) |
| Mouse | 100 |
Подробная информация о протоколе инъекции AAV в животных in vivo представлена в руководстве пользователя AAV.
10. Адено-ассоциированный вирус (AAV-вектор) - Протокол производства, руководства и ссылки
Протокол производства AAV -- Genemedi
1. Конструкция плазмид AAV
Целевой ген клонируется в один из AAV-векторов, содержащих ITR/MCS, для создания AAV-GOI. Необходимо учитывать чистоту и загрязнение РНКазой вирусной плазмиды AAV.
2. Упаковка AAV
Рекомбинантная вирусная плазмида AAV-GOI совместно транфицируется в клетки AAV-293 с помощью вспомогательной плазмиды AAV pHelper (несущей гены, происходящие от аденовируса) и AAV-RC (несущей гены репликации и капсида AAV-2), которые вместе обеспечивают все транс-действующие факторы, необходимые для репликации и упаковки AAV в клетках AAV-293.
3. Сбор частиц AAV
Собирают клетки и подвергают их замораживанию/размораживанию, чтобы высвободить вирус AAV.
4. Очищение AAV
Очищают вирус AAV с помощью градиентного ультрацентрифугирования для отделения загрязнителей от неочищенных препаратов AAV.
5. Определение титра AAV
Определяют титр AAV с помощью количественной ПЦР в реальном времени (QPCR), используя праймеры, нацеленные на ITR AAV. Значения титра затем идентифицируются путем сравнения со стандартной кривой образца плазмиды известной концентрации.
6. Контроль качества AAV
После определения титра вируса AAV необходимо оценить активность инфекции перед экспериментами на животных, инфицируя клетки, такие как 293T, CHO, для тестирования экспрессии гена. MOI для AAV-опосредованной генной трансдукции в клетках будет контролироваться в диапазоне от 10^4 до 10^5.
Adeno-associated virus (AAV vector) - Guidelines
| NIH Guidelines for Adeno-Associated (AAV) Lentivirus and Adenovirus | Guidance for Gene Therapy Clinical trials-FDA | Human Gene Therapy for Hemophilia |
| Human Gene Therapy For Rare Diseases | Human Gene Therapy for Retinal Disorders |
1. Atchison RW, BC Casto and WM Hammon. (1965). Adenovirus-Associated Defective Virus Particles. Science 149:754-6.
2. Hoggan MD, NR Blacklow and WP Rowe. (1966). Studies of small DNA viruses found in various adenovirus preparations: physical, biological, and immunological characteristics. Proc Natl Acad Sci U S A 55:1467-74.
3. Wu Z, A Asokan and RJ Samulski. (2006). Adeno-associated virus serotypes: vector toolkit for human gene therapy. Mol Ther 14:316-27.
4. Vectors used in gene therapy clinical trials. The Journal of Gene Medicine Online Library. [Online] Updated Nov 2017. http://www.abedia.com/wiley/vectors.php.
5. Zsigmond E, K Kobayashi, KW Tzung, L Li, Y Fuke and L Chan.
(1997). Adenovirus-mediated gene transfer of human lipoprotein lipase ameliorates the hyperlipidemias associated with apolipoprotein E and LDL receptor deficiencies in mice. Hum Gene Ther 8:1921-33.
6. Passini MA, J Bu, AM Richards, CM Treleaven, JA Sullivan, CR O'Riordan, A Scaria, AP Kells, L Samaranch, W San Sebastian, T Federici, MS Fiandaca, NM Boulis, KS Bankiewicz, LS Shihabuddin and SH Cheng. (2014). Translational fidelity of intrathecal delivery of self-complementary AAV9-survival motor neuron 1 for spinal muscular atrophy. Hum Gene Ther 25:619-30.
7. Stieger K and B Lorenz. (2014). [Specific gene therapy for hereditary retinal dystrophies - an update]. Klin Monbl Augenheilkd 231:210-5.
8. Trapani I, P Colella, A Sommella, C Iodice, G Cesi, S de Simone, E Marrocco, S Rossi, M
Giunti, A Palfi, GJ Farrar, R Polishchuk and A Auricchio. (2014). Effective delivery of large genes to the retina by dual AAV vectors. EMBO Mol Med 6:194-211.
9. Doi K and Y Takeuchi. (2015). Gene therapy using retrovirus vectors: vector development and biosafety at clinical trials. Uirusu 65:27-36.
10. Duncan GA, N Kim, Y Colon-Cortes, J Rodriguez, M Mazur, SE Birket, SM Rowe, NE West, A Livraghi-Butrico, RC Boucher, J Hanes, G Aslanidi and JS Suk. (2018). An Adeno-Associated Viral Vector Capable of Penetrating the Mucus Barrier to Inhaled Gene Therapy. Mol Ther Methods Clin Dev 9:296-304.
11. Bowles DE, SW McPhee, C Li, SJ Gray, JJ Samulski, AS Camp, J Li, B Wang, PE Monahan, JE Rabinowitz, JC Grieger, L Govindasamy, M Agbandje-McKenna, X Xiao and RJ Samulski. (2012). Phase 1 gene
therapy for Duchenne muscular dystrophy using a translational optimized AAV vector. Mol Ther 20:443-55.
12. Nathwani AC, EG Tuddenham, S Rangarajan, C Rosales, J McIntosh, DC Linch, P Chowdary, A Riddell, AJ Pie, C Harrington, J O'Beirne, K Smith, J Pasi, B Glader, P Rustagi, CY Ng, MA Kay, J Zhou, Y Spence, CL Morton, J Allay, J Coleman, S Sleep, JM Cunningham, D Srivastava, E Basner-Tschakarjan, F Mingozzi, KA High, JT Gray, UM Reiss, AW Nienhuis and AM Davidoff. (2011). Adeno-associated virus vector-mediated gene transfer in hemophilia B. N Engl J Med 365:2357-65.
13. Jessup M, B Greenberg, D Mancini, T Cappola, DF Pauly, B Jaski, A Yaroshinsky, KM Zsebo, H Dittrich, RJ Hajjar and I Calcium Upregulation by Percutaneous Administration of Gene Therapy in Cardiac Disease. (2011). Calcium Upregulation by Percutaneous Administration of Gene
Therapy in Cardiac Disease (CUPID): a phase 2 trial of intracoronary gene therapy of sarcoplasmic reticulum Ca2+-ATPase in patients with advanced heart failure. Circulation 124:304-13.
14. LeWitt PA, AR Rezai, MA Leehey, SG Ojemann, AW Flaherty, EN Eskandar, SK Kostyk, K Thomas, A Sarkar, MS Siddiqui, SB Tatter, JM Schwalb, KL Poston, JM Henderson, RM Kurlan, IH Richard, L Van Meter, CV Sapan, MJ During, MG Kaplitt and A Feigin. (2011). AAV2-GAD gene therapy for advanced Parkinson's disease: a double-blind, sham-surgery controlled, randomised trial. Lancet Neurol 10:309-19.
15. Mease PJ, N Wei, EJ Fudman, AJ Kivitz, J Schechtman, RG Trapp, KF Hobbs, M Greenwald, A Hou, SA Bookbinder, GE Graham, CW Wiesenhutter, L Willis, EM Ruderman, JZ Forstot, MJ Maricic, KH Dao, CH Pritchard, DN Fiske, FX Burch, HM Prupas, P Anklesaria and AE Heald. (2010).
Safety, tolerability, and clinical outcomes after intraarticular injection of a recombinant adeno-associated vector containing a tumor necrosis factor antagonist gene: results of a phase 1/2 Study. J Rheumatol 37:692-703.
16. Evans CH, SC Ghivizzani and PD Robbins. (2018). Gene Delivery to Joints by Intra-Articular Injection. Hum Gene Ther 29:2-14.
17. Gupta PR and RM Huckfeldt. (2017). Gene therapy for inherited retinal degenerations: initial successes and future challenges. J Neural Eng 14:051002.
18. Polinski NK, SE Gombash, FP Manfredsson, JW Lipton, CJ Kemp, A Cole-Strauss, NM Kanaan, K Steece-Collier, NC Kuhn, SL Wohlgenant and CE Sortwell. (2015). Recombinant adenoassociated virus 2/5-mediated gene transfer is reduced in the aged rat midbrain. Neurobiol Aging 36:1110-20.
19. Moore T. (2005). Restoring retinal function in a mouse model of hereditary blindness. PLoS Med 2:e399.
20. Russell S, J Bennett, JA Wellman, DC Chung, ZF Yu, A Tillman, J Wittes, J Pappas, O Elci, S McCague, D Cross, KA Marshall, J Walshire, TL Kehoe, H Reichert, M Davis, L Raffini, LA George, FP Hudson, L Dingfield, X Zhu, JA Haller, EH Sohn, VB Mahajan, W Pfeifer, M Weckmann, C Johnson, D Gewaily, A Drack, E Stone, K Wachtel, F Simonelli, BP Leroy, JF Wright, KA High and AM Maguire. (2017). Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: a randomised, controlled, open-label, phase 3 trial. Lancet 390:849-860.
21. Dulsat C. (2017). American Academy of Neurology - 69th Annual Meeting (April 22-28, 2017 - Boston, Massachusetts,
USA). Drugs Today (Barc) 53:309-319.
22. Annexstad EJ, I Lund-Petersen and M Rasmussen. (2014). Duchenne muscular dystrophy. Tidsskr Nor Laegeforen 134:1361-4.
23. Blankinship MJ, P Gregorevic and JS Chamberlain. (2006). Gene therapy strategies for Duchenne muscular dystrophy utilizing recombinant adeno-associated virus vectors. Mol Ther 13:241-9.
24. Kawecka K, M Theodoulides, Y Hasoglu, S Jarmin, H Kymalainen, A Le-Heron, L Popplewell, A Malerba, G Dickson and T Athanasopoulos. (2015). Adeno-Associated Virus (AAV) Mediated Dystrophin Gene Transfer Studies and Exon Skipping Strategies for Duchenne Muscular Dystrophy (DMD). Curr Gene Ther 15:395-415.
25. Kodippili K, CH Hakim, X Pan, HT Yang, Y Yue, Y Zhang, JH Shin, NN Yang and D
Duan. (2018). Dual AAV Gene Therapy for Duchenne Muscular Dystrophy with a 7-kb Mini-Dystrophin Gene in the Canine Model. Hum Gene Ther 29:299-311.
26. Duan D. (2018). Systemic AAV Micro-dystrophin Gene Therapy for Duchenne Muscular Dystrophy. Mol Ther 26:2337-2356.
27. Santagostino E and MR Fasulo. (2013). Hemophilia a and hemophilia B: different types of diseases? Semin Thromb Hemost 39:697-701.
28. Nichols T, MH Whitford, VR Arruda, HH Stedman, MA Kay and KA High. (2014). Translational Data from AAV-Mediated Gene Therapy of Hemophilia B in Dogs. Hum Gene Ther Clin Dev.
29. Crudele JM, JD Finn, JI Siner, NB Martin, GP Niemeyer, S Zhou, F Mingozzi, CD Lothrop, Jr. and VR Arruda. (2015). AAV liver expression of FIX-Padua prevents and
eradicates FIX inhibitor without increasing thrombogenicity in hemophilia B dogs and mice. Blood 125:1553-61.
30. Hasbrouck NC and KA High. (2008). AAV-mediated gene transfer for the treatment of hemophilia B: problems and prospects. Gene Ther 15:870-5.
31. Brimble MA, UM Reiss, AC Nathwani and AM Davidoff. (2016). New and improved AAVenues: current status of hemophilia B gene therapy. Expert Opin Biol Ther 16:79-92.
32. Grieger JC and RJ Samulski. (2005). Packaging capacity of adeno-associated virus serotypes: impact of larger genomes on infectivity and postentry steps. J Virol 79:9933-44.
33. Selot RS, S Hareendran and GR Jayandharan. (2014). Developing immunologically inert adeno-associated virus (AAV) vectors for gene therapy:
possibilities and limitations. Curr Pharm Biotechnol 14:1072-82.
34. Bartlett JS, R Wilcher and RJ Samulski. (2000). Infectious entry pathway of adeno-associated virus and adeno-associated virus vectors. J Virol 74:2777-85.
35. Ding W, L Zhang, Z Yan and JF Engelhardt. (2005). Intracellular trafficking of adeno-associated viral vectors. Gene Ther 12:873-80.
36. Srivastava A. (2008). Adeno-associated virus-mediated gene transfer. J Cell Biochem 105:17-24.
37. Berns KI. (1990). Parvovirus replication. Microbiol Rev 54:316-29.
38. Pereira DJ, DM McCarty and N Muzyczka. (1997). The adeno-associated virus (AAV) Rep protein acts as both a repressor and an activator to regulate AAV
transcription during a productive infection. J Virol 71:1079-88.
39. Calcedo R and JM Wilson. (2013). Humoral Immune Response to AAV. Front Immunol 4:341.
40. Mingozzi F and KA High. (2013). Immune responses to AAV vectors: overcoming barriers to successful gene therapy. Blood 122:23-36.
41. Weitzman MD and RM Linden. (2011). Adeno-associated virus biology. Methods Mol Biol 807:1-23.
42. Gao G, MR Alvira, S Somanathan, Y Lu, LH Vandenberghe, JJ Rux, R Calcedo, J Sanmiguel, Z Abbas and JM Wilson. (2003). Adeno-associated viruses undergo substantial evolution in primates during natural infections. Proc Natl Acad Sci U S A 100:6081-6.
43. Hauck B, L Chen and W Xiao. (2003).
Generation and characterization of chimeric recombinant AAV vectors. Mol Ther 7:419-25.
44. Rabinowitz JE, DE Bowles, SM Faust, JG Ledford, SE Cunningham and RJ Samulski. (2004). Cross-dressing the virion: the transcapsidation of adeno-associated virus serotypes functionally defines subgroups. J Virol 78:4421-32.
45. Manno CS, AJ Chew, S Hutchison, PJ Larson, RW Herzog, VR Arruda, SJ Tai, MV Ragni, A Thompson, M Ozelo, LB Couto, DG Leonard, FA Johnson, A McClelland, C Scallan, E Skarsgard, AW Flake, MA Kay, KA High and B Glader. (2003). AAV-mediated factor IX gene transfer to skeletal muscle in patients with severe hemophilia B. Blood 101:2963-72.
46. Bartlett JS, RJ Samulski and TJ McCown. (1998). Selective and rapid uptake of adeno-associated virus type 2 in brain. Hum Gene Ther
9:1181-6.
47. Richter M, A Iwata, J Nyhuis, Y Nitta, AD Miller, CL Halbert and MD Allen. (2000). Adeno-associated virus vector transduction of vascular smooth muscle cells in vivo. Physiol Genomics 2:117-27.
48. Koeberl DD, IE Alexander, CL Halbert, DW Russell and AD Miller. (1997). Persistent expression of human clotting factor IX from mouse liver after intravenous injection of adeno-associated virus vectors. Proc Natl Acad Sci U S A 94:1426-31.
49. Pajusola K, M Gruchala, H Joch, TF Luscher, S Yla-Herttuala and H Bueler. (2002). Cell-type-specific characteristics modulate the transduction efficiency of adeno-associated virus type 2 and restrain infection of endothelial cells. J Virol 76:11530-40.
50. Qing K, C Mah, J Hansen, S Zhou,
V Dwarki and A Srivastava. (1999). Human fibroblast growth factor receptor 1 is a co-receptor for infection by adeno-associated virus 2. Nat Med 5:71-7.
51. Summerford C and RJ Samulski. (1998). Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol 72:1438-45.
52. Summerford C, JS Bartlett and RJ Samulski. (1999). AlphaVbeta5 integrin: a co-receptor for adeno-associated virus type 2 infection. Nat Med 5:78-82.
53. Shi W, A Hemminki and JS Bartlett. (2006). Capsid modifications overcome low heterogeneous expression of heparan sulfate proteoglycan that limits AAV2-mediated gene transfer and therapeutic efficacy in human ovarian carcinoma. Gynecol Oncol 103:1054-62.
54. Wang Z,
T Zhu, C Qiao, L Zhou, B Wang, J Zhang, C Chen, J Li and X Xiao. (2005). Adeno-associated virus serotype 8 efficiently delivers genes to muscle and heart. Nat Biotechnol 23:321-8.
55. Nakai H, S Fuess, TA Storm, S Muramatsu, Y Nara and MA Kay. (2005). Unrestricted hepatocyte transduction with adeno-associated virus serotype 8 vectors in mice. J Virol 79:214-24.
56. Gao G, LH Vandenberghe, MR Alvira, Y Lu, R Calcedo, X Zhou and JM Wilson. (2004). Clades of Adeno-associated viruses are widely disseminated in human tissues. J Virol 78:6381-8.
57. Saraiva J, RJ Nobre and L Pereira de Almeida. (2016). Gene therapy for the CNS using AAVs: The impact of systemic delivery by AAV9. J Control Release 241:94-109.
58. Alisky JM, SM Hughes, SL
Sauter, D Jolly, TW Dubensky, Jr., PD Staber, JA Chiorini and BL Davidson. (2000). Transduction of murine cerebellar neurons with recombinant FIV and AAV5 vectors. Neuroreport 11:2669-73.
59. Burger C, OS Gorbatyuk, MJ Velardo, CS Peden, P Williams, S Zolotukhin, PJ Reier, RJ Mandel and N Muzyczka. (2004). Recombinant AAV viral vectors pseudotyped with viral capsids from serotypes 1, 2, and 5 display differential efficiency and cell tropism after delivery to different regions of the central nervous system. Mol Ther 10:302-17.
60. Davidson BL, CS Stein, JA Heth, I Martins, RM Kotin, TA Derksen, J Zabner, A Ghodsi and JA Chiorini. (2000). Recombinant adeno-associated virus type 2, 4, and 5 vectors: transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci U S A 97:3428-32.
61. Gao GP, MR Alvira, L Wang, R Calcedo, J Johnston and JM Wilson. (2002). Novel adeno-associated viruses from rhesus monkeys as vectors for human gene therapy. Proc Natl Acad Sci U S A 99:11854-9.
62. Chao H, Y Liu, J Rabinowitz, C Li, RJ Samulski and CE Walsh. (2000). Several log increase in therapeutic transgene delivery by distinct adeno-associated viral serotype vectors. Mol Ther 2:619-23.
63. Blankinship MJ, P Gregorevic, JM Allen, SQ Harper, H Harper, CL Halbert, AD Miller and JS Chamberlain. (2004). Efficient transduction of skeletal muscle using vectors based on adeno-associated virus serotype 6. Mol Ther 10:671-8.
64. Halbert CL, JM Allen and AD Miller. (2001). Adeno-associated virus type 6 (AAV6) vectors mediate efficient transduction of
airway epithelial cells in mouse lungs compared to that of AAV2 vectors. J Virol 75:6615-24.
65. Kotterman MA and DV Schaffer. (2014). Engineering adeno-associated viruses for clinical gene therapy. Nat Rev Genet 15:445-51.
66. Zhong L, B Li, CS Mah, L Govindasamy, M Agbandje-McKenna, M Cooper, RW Herzog, I Zolotukhin, KH Warrington, Jr., KA Weigel-Van Aken, JA Hobbs, S Zolotukhin, N Muzyczka and A Srivastava. (2008). Next generation of adeno-associated virus 2 vectors: point mutations in tyrosines lead to high-efficiency transduction at lower doses. Proc Natl Acad Sci U S A 105:7827-32.
67. Lochrie MA, GP Tatsuno, B Christie, JW McDonnell, S Zhou, R Surosky, GF Pierce and P Colosi. (2006). Mutations on the external surfaces of adeno-associated virus type 2 capsids that affect transduction
and neutralization. J Virol 80:821-34.
68. Munch RC, H Janicki, I Volker, A Rasbach, M Hallek, H Buning and CJ Buchholz. (2013). Displaying high-affinity ligands on adeno-associated viral vectors enables tumor cell-specific and safe gene transfer. Mol Ther 21:109-18.
69. Grimm D and S Zolotukhin. (2015). E Pluribus Unum: 50 Years of Research, Millions of Viruses, and One Goal--Tailored Acceleration of AAV Evolution. Mol Ther 23:1819-31.
70. Maheshri N, JT Koerber, BK Kaspar and DV Schaffer. (2006). Directed evolution of adeno-associated virus yields enhanced gene delivery vectors. Nat Biotechnol 24:198-204.
71. Khabou H, M Desrosiers, C Winckler, S Fouquet, G Auregan, AP Bemelmans, JA Sahel and D Dalkara. (2016). Insight into the
mechanisms of enhanced retinal transduction by the engineered AAV2 capsid variant -7m8. Biotechnol Bioeng 113:2712-2724.
72. Kienle E, E Senis, K Borner, D Niopek, E Wiedtke, S Grosse and D Grimm. (2012). Engineering and evolution of synthetic adeno-associated virus (AAV) gene therapy vectors via DNA family shuffling. J Vis Exp.
Other knowledge bases
| AAV Knowledge Base | Adenovirus Knowledge Base | Lentivirus Knowledge Base |







 Facebook
Facebook LinkedIn
LinkedIn Twitter
Twitter
