Основные элементы антитело-лекарственного конъюгата (Antibody-Drug Conjugate, ADC): Линкер (разделяемый/нераскалываемый, структура и механизм действия)
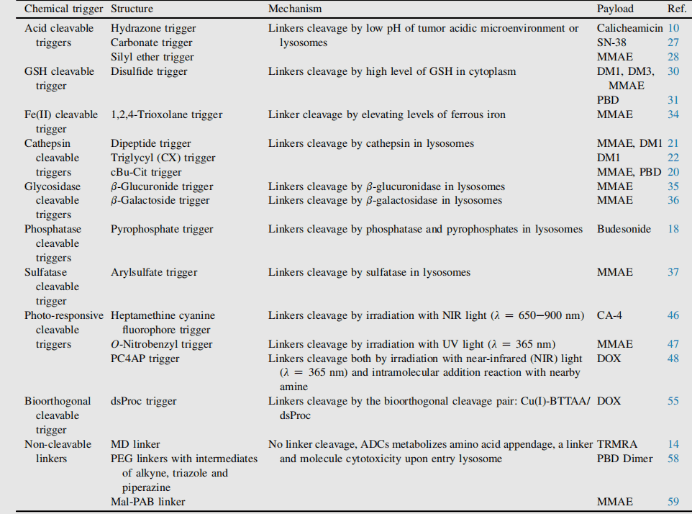
Конъюгированный линкер не только является молекулярной частью, формирующей ковалентную связь между антителом и малой молекулой-пейлоадом (payload), но и ключевым элементом с точки зрения проектирования в таргетной лекарственной терапии. Добавление линкеров не должно вызывать агрегацию, а также необходимо обеспечить приемлемые фармакокинетические (pharmacokinetics, PK) характеристики, ограничить преждевременный высвобождение пейлоада в плазме (стабильность) и эффективно высвобождать активные молекулы в целевых участках действия. В процессе соединения существует множество компаний, занимающихся конъюгацией. Линкеры делятся на два типа: нерасщепляемые (non-cleavable) и расщепляемые (cleavable)1.
ADC на основе нерасщепляемого линкера должны быть интернализированы, и антитело должно быть расщеплено лизосомальными протеазами для высвобождения активных молекул. Было исследовано множество неразрезанных линкеров в разработке ADC, наиболее представительным из которых является n-сукцинимид-4-(n-малеимидаметил) циклогексан-1-карбоксилат (SMCC, SMCC), используемый в Kadcyla®2.
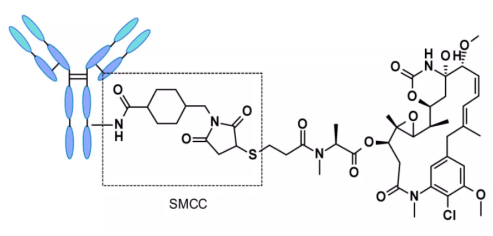
Катаболизм данной структуры приводит к тому, что lys-smc-dm1 становится основным метаболитом опухоли. Кроме того, препараты, связанные с данным линкером, обычно не обладают эффектом "байстрендер" (bystander killing/bystander effect), поскольку высвобождаемые метаболиты обладают низкой проницаемостью. В настоящее время исследования сосредоточены преимущественно на расщепляемых линкерах[6-7].
Применение расщепляемых линкеров является одинаково осуществимым при проектировании как интернализированных, так и неинтернализированных ADC, поскольку высвобождение запускается свойствами области расщепления (лиосома и/или опухолевая среда). Линкеры можно разделить на две категории: зависимые от ферментов (enzyme dependent) и химически зависимые (non enzyme dependent) (оба типа используются при производстве конъюгатов).
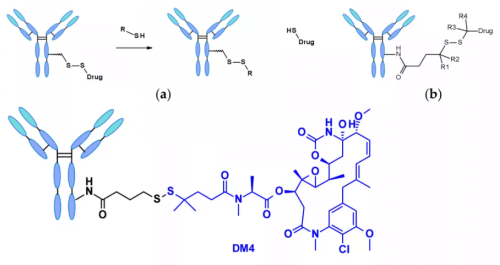
Химически зависимый линкер: Линкер, содержащий дисульфидную связь, атакуется меркаптаном (mercaptan) с последующим высвобождением активного пейлоада. Хотя редуцированная форма человеческого сывороточного альбумина (human serum albumin, HSA) в плазме является наиболее обильным меркаптаном, его реакционная способность с макромолекулами очень низка3. В цитоплазме также содержится высокое количество глутатиона (glutathione, GSH), трипептида, содержащего сульфгидрильную группу, который легко реагирует с S-нуклеофильными белками. Разница в концентрации GSH в крови (микромолярный диапазон) и цитоплазме (миллимолярный диапазон), а также окислительный стресс, вызванный раковыми клетками, способствуют предпочтительному высвобождению лекарств в раковых клетках. Линкеры, содержащие дисульфидные связи, в основном применяются для пейлоадов, относящихся к майтансиноидам (maytansinoid). Реакционную способность дисульфидных связей можно регулировать за счёт стерического эффекта: α-метиловая замена значительно влияет на скорость восстановления и устойчивость к обмену дисульфидных связей с меркаптаном. Например, линкер sar-3419 благодаря диметиловой замене обеспечивает наилучшую противоопухолевую активность spdb-DM4.
Гидразоновые линкеры демонстрируют pH-зависимую стабильность: они стабильны при нейтральном pH, но гидролизуются в кислой среде (pH < 6 в эндосомах и pH < 5 в лизосомах), образуя соответствующие кетоны и гидразины.
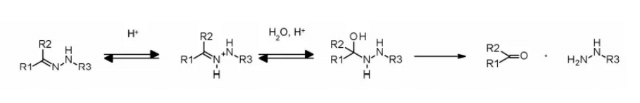
Данный метод успешно применён в immu-110, который содержит расщепляемый ацилированный гидразоновый линкер, образующийся в результате реакции гидразида 4-малеимидаметилцикло헥сан-1-карбоксилата (MCC, MCC) с кетонной группой, присутствующей в адриамицине.
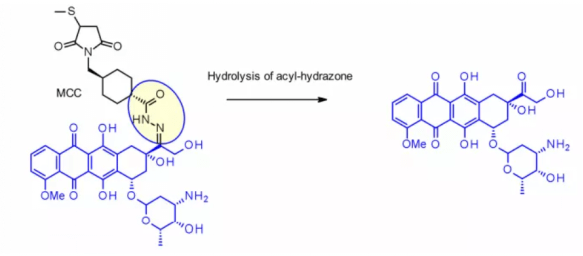
Гидразоновые линкеры также часто используются для пейлоадов семейства калимицина (calimycin). В этом случае высвобождение запускается двухступенчатым процессом: сначала чувствительный к кислоте гидразон гидролизуется, а затем дисульфидная связь восстанавливается глутатионом (GSH), что приводит к циклизации интермедиата сульфгидрильной группы. Этот линкер использовался в Mylotarg® и Besponsa®, однако его стабильность в плазме оказалась ниже ожидаемой и менее привлекательной по сравнению с другими расщепляемыми линкерами.
Энзимозависимый линкер: С целью ограничения высвобождения пейлоада до интернализации, чтобы предотвратить или минимизировать деградацию целевых клеток, логично искать ферменты, способные разрушать ADC, в высококонцентрированных белковых компонентах лизосом.
Катепсин B
Катепсин B – это цистеиновая протеаза, которая присутствует в поздних эндосомах и лизосомах млекопитающих и часто чрезмерно экспрессируется в раковых клетках. Первоначально в качестве субстрата для катепсина B использовался расщепляемый дипептид для про-друга адриамицина. Это исследование установило, что в дипептидной части SAR требуется наличие гидрофильных остатков (цитруллин или аргинин) на позиции P1, в то время как липофильные остатки на позиции P2 (фенилаланин, валин или аланин) повышают стабильность в плазме.
Кроме того, для улучшения доступа фермента был введён самораспадающийся спейсер, что снижает стерическое затруднение со стороны пейлоада: в кислой среде происходит спонтанная 1,6-элиминация p-аминобензилкарбамата (PABA, PABA) с высвобождением углекислого газа, p-азакинонформамида и адриамицина. Это открытие затем было перенесено из области продрогов в сферу ADC, продемонстрировав антиген-обусловленную клеточную активность дипептидных линкеров Val-Cit и Phe-Lys4.
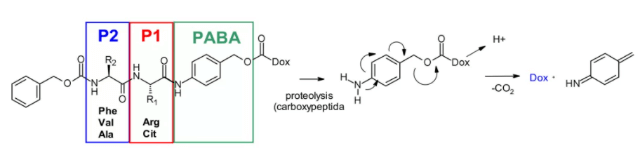
Дипептид Val-Cit является наиболее часто используемым расщепляемым линкером в ADC. В настоящее время до 25 молекул находятся на клинической стадии, что обусловлено его общей высокой стабильностью в плазме, режимом высвобождения и химической обработкой. Два одобренных ADC (Adcetris® и Polyvy®) используют один и тот же линкер MC VC PABC, который включает малеимида-спейсер, стандартную дипептидную последовательность Val-Cit в качестве субстрата для катепсина и самораспадающийся спейсер PABC.
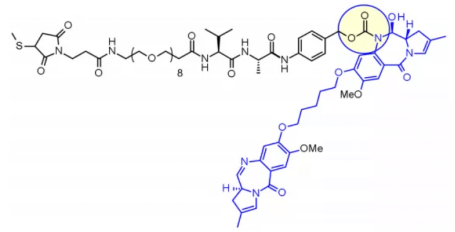
Дипептид Val-Ala также широко используется. В клинической стадии представлено семь молекул. Наиболее быстрый прогресс наблюдается у loncastuximab tesirine, который включает PEG-спейсер для уравновешивания липофильности пейлоада sg3199, принадлежащего к семейству PBD-диамеров.
Исследования показывают, что из-за осаждения и агрегации Val-Cit сложно достичь высокого DAR (Drug-to-Antibody Ratio, DAR), в то время как линкер Val-Ala позволяет достичь DAR до 7,4 при ограниченной агрегации (< 10%). По сравнению с Val-Cit, Val-Ala имеет более низкую гидрофобность, что объясняет его превосходство при работе с липофильными пейлоадами, такими как PBD-диамер. В семи клинических кандидатах ADC используется линкер Val-Ala, соединённый с PBD.
Некоторые исследования сравнили структуру дипептидов Val-Cit и Val-Ala в сочетании с пейлоадом MMAE. В случае неинтернализированных антител, Val-Cit и Val-Ala, связанные с инженерно модифицированным цистеином, продемонстрировали схожие характеристики и лучшее действие по сравнению с аналогами Val-Lys и Val-Arg. При анти-HER2 ADC с рандомным связыванием цистеина Val-Ala показал меньшую агрегацию в высоких структурах DAR по сравнению с Val-Cit. С другой стороны, оба линкера показали схожую стабильность в буфере, эффективность высвобождения катепсином B, клеточную активность и гистопатологические характеристики.
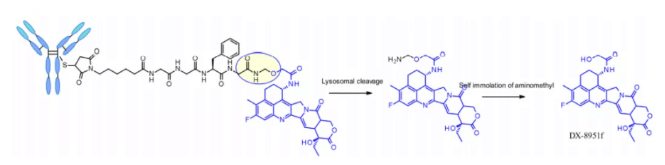
Четырёхпептид Gly-Gly-Phe-Gly демонстрирует все характеристики стабильных и эффективных расщепляемых линкеров и используется в ADC препарата Enhertu®. Первая фаза Enhertu представляет собой стабильно действующий в плазме ADC с DAR равным 7,7. Протеолитическое разрушение происходит в лизосомах, вследствие чего высвобождается dx-8951f – эффективный ингибитор топоизомеразы I, полученный из Exatecan. Поскольку данный линкер не содержит растворителей, достижение такого высокого DAR является значительным, так как это противоречит широко принятому принципу, что высоко конъюгированные соединения могут обладать низкими фармакокинетическими характеристиками. Здесь используемый самораспадающийся спейсер представляет собой простой и компактный гемиаминонен, а не PABC, используемый в линкере Val-Cit.
Фосфатаза и пирофосфатаза
Подобно катепсину, пирофосфатаза и фосфатаза являются гидролазами, которые селективно экспрессируются в лизосомах. В 2016 году исследователи Merck разработали линкер, содержащий фосфат и пирофосфат, который в сочетании с катепсин B-чувствительным Val-Cit PABA использовался для передачи глюкокортикоидов: фосфат/пирофосфат частично связывается между самораспадающимся спейсером PABA и пейлоадом. После интернализации пейлоад высвобождается в порядке: катепсин B, самораспадающийся спейсер и фосфатаза (n = 1). При пирофосфате (n = 2) может потребоваться дополнительный этап с участием пирофосфатазы.
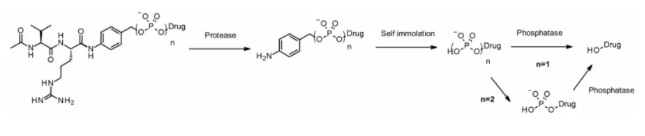
Эта гидрофильная и постоянно заряженная группа обладает преимуществом высокой растворимости. Она может не только биосвязываться с липофильными производными глюкокортикоидов, но и способствовать очистке ADC. Остаток линкера в ADC составляет менее 0,10%. ADC, содержащие фосфорную и пирофосфорную кислоты, демонстрируют активность in vitro.
β-Глюкуронидаза
β-Глюкуронидазы – это гликозидазы, катализирующие β-гидролиз остатков глюкуроновой кислоты, которые высоко экспрессируются в лизосомах и опухолевом строме. Исследователи из Seattle Genetics в 2006 году опубликовали прорывное исследование, в котором анти-CD70 ADC использовал линкер, содержащий глюкуроновую кислоту, прикреплённую к самораспадающемуся спейсеру. Этот линкер характеризуется низкой агрегацией, высокой стабильностью в плазме и сильной in vivo эффективностью5.
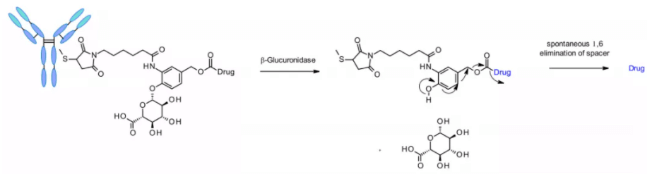
Линкер также применяется для других пейлоадов, содержащих аминогруппы, таких как аналоги камптотекина, SN38, дукамаицин и матрин, посредством дополнительного самораспадающегося спейсера из диметилэтилендиамина (DMED, DMED). После гидролиза, от глюкуроновой кислоты к спейсеру, спонтанно происходит цикллизация DMED, образуя 1,3-диметилимидазолин-2-он, и, наконец, происходит высвобождение препаратов, содержащих гидроксильную группу. Благодаря гидрофильности линкера, по сравнению с линкерами, чувствительными к катепсину, эта технология облегчает подготовку ADC с DAR = 8.
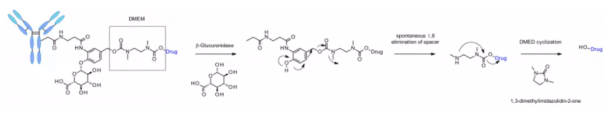
β-Галактидаза
Недавно был разработан метод, использующий β-Галактидазу для расщепления линкера в ADC, содержащего PEG10-спейсер. Этот спейсер заменён нитрогруппой для повышения скорости самораспада. Механизм диссоциации данного линкера аналогичен β-Глюкуронидазному, при котором происходит гидролиз β-Галактидазного фрагмента, придающего химическим предшественникам гидрофильность. Еще одним преимуществом является то, что β-Галактидаза экспрессируется исключительно в лизосомах, в то время как β-Глюкуронидаза обнаруживается как в лизосомах, так и в микросреде твердых опухолей. Исследования показали, что в контексте анти-HER2 ADC, высвобождающего MMAE, ADC с β-Галактидазным линкером эффективнее, чем t-DM1, как in vitro, так и in vivo.
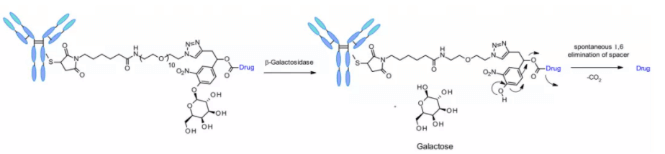
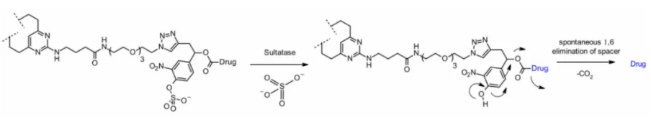
Сульфатаза
В последнее время появились линкеры, расщепляемые сульфатазой, которая в некоторых типах рака экспрессируется в избытке и демонстрирует потенциальную избирательность. Исследование проводилось с использованием анти-HER2 антител, загруженных MMAE. По сравнению с классическими расщепляемыми линкерами Val-Cit и Val-Ala, сульфатазный линкер показал сходную эффективность на клеточных линиях HER2+.
Reference:







 Посмотреть базу знаний по антитело-лекарственному конъюгату (ADC):
Посмотреть базу знаний по антитело-лекарственному конъюгату (ADC): Facebook
Facebook LinkedIn
LinkedIn Twitter
Twitter
